KRYSZTAŁY – PODRĘCZNIK DLA NAUCZYCIELI
Elizabeth A. Wood, 1972
Napisany dla Komisji Nauczania Krystalografii Międzynarodowej Unii Krystalografii
W S T Ę P
Do Nauczycieli dzieci szkolnych we wszystkich krajach:
Ta książeczka została napisana dla Komisji Nauczania Międzynarodowej Unii Krystalografii, która jest organizacją na rzecz wiedzy krystalograficznej na całym świecie. Nie jest to Unia handlowa, ale grupa ludzi zainteresowanych kryształami, należących do wszystkich narodowości.
Wielu nauczycieli dostrzegło, że dzieci interesują się kryształami. Jest to dobry powód dla nauczyciela, aby popierać to zainteresowanie. Dzieci mogą wykonywać proste doświadczenia z kryształami i w ten sposób odczuć, że same tworzą wiedzę, nabierają umiejętności obserwacji, co dzieje się w ich własnych doświadczeniach. Kryształy interesują chemików, fizyków, geologów, biologów i matematyków. Badać kryształy to uczestniczyć w tych wszystkich dziedzinach i przekonać się, że Natura nie jest rozdzielona na chemię, fizykę, geologie i biologię.
Większość nauczycieli w naszych czasach ( lata siedemdziesiąte) nie uczyła się o kryształach w trakcie nauki w szkole i na uniwersytecie. Celem tej książeczki jest danie im pewnych podstaw do rozumienia czym są kryształy, tak aby mogli oni z powodzeniem pracować z dziećmi interesującymi się kryształami. Nie jest to systematyczny kurs krystalografii. To nie byłoby wystarczające. Studiujący, którzy chcą wiedzieć więcej o krystalografii, powinni studiować ją na uniwersytecie. Ten podręcznik ma sprawić wam przyjemność.
W tej książeczce unikamy wyrażeń technicznych jak to tylko jest możliwe, nie po to, aby uczynić ją łatwiejszą, ale aby uniknąć pułapki polegającej na zastępowaniu myślenia o tym co się dzieje, przez naukę nazw. Dzieci myślą, że wiedzą dlaczego jabłko spada, dlatego, że nauczyły się słowa „ siła ciężkości” ale nasi bardziej kompetentni naukowcy mają problemy ze sposobem, w jaki jabłko i Ziemia są nawzajem przyciągane.
Większość książek o krystalografii, o przedmiocie związanym z badaniem kryształów, podkreśla wagę symetrii w klasyfikacji kryształów. Jednakże wiele kryształów, które dzieci mogą wyhodować lub znaleźć w przyrodzie, ma kształty, które nie wykazują doskonałej symetrii, gdyż warunki wzrostu nie były identyczne wokół kryształu. Trzeba dojrzałej wyobraźni i doświadczenia z kryształami doskonale symetrycznymi, aby wyobrazić sobie jak taki kryształ wyglądałby, gdyby warunki wzrostu były równomierne.
Jeśli uczniowie nie mogą być przekonani na podstawie własnych obserwacji, że symetria jest rzeczywiście użyteczna w klasyfikacji kryształów, nie ma uzasadnienia, aby musieli pamiętać pojęcia symetrii, skoro one nie mają dla nich znaczenia. Istotą wiedzy jest obserwacja i zdumienie, ciekawość i wysiłek w zaspokajaniu tej ciekawości. Wiedza o tym, co inni odkryli, jest częścią wiedzy o nauce, ale najpierw my sami winniśmy zobaczyć jak naukowcy doszli do swej wiedzy o przyrodzie, tak abyśmy byli przekonani, że ich wyniki są oparte na powtarzalnych doświadczeniach.
Z tych przyczyn książeczka ta nie zajmuje się systematyczną krystalografią, klasyfikacją kryształów według ich symetrii. Ma stanowić mocną podstawę do dalszych studiów krystalografii przez zachętę do obserwacji i doświadczeń. Po jakimś czasie obserwacje uczniowskie doprowadzą ich zapewne do takich wniosków:
- W odpowiednich warunkach pewne rodzaje materii stałej przybierają postaci zwane kryształami.
- Kryształy rosną większe przez dodawanie im materiału z zewnątrz.
- Kryształy powstają z roztworu, gdy rozpuszczalnik odparowuje. Kryształy powstają ze stanu stopionego, gdy płyn stygnie. Kryształy powstają z gorącej niewidzialnej pary, gdy ta para zetknie się z zimną powierzchnią.
- Kryształy różnych substancji mają różne postaci.
- Kryształy różnych substancji mają różne właściwości; niektóre są barwne, a inne nie; jedne rosną łatwo, a inne nie; jedne wykazują łupliwość (co omówimy później), a inne nie; jedne błyszczą między skrzyżowanymi polaryzatorami (patrz rozdział 3-D), a inne nie.
- (dla starszych uczniów) Muszą być jakieś zasady wzrostu kryształu, decydujące o powstawaniu płaskich ścian, charakterystycznego kształtu i sposobu oddziaływania ze światłem. Te zasady muszą być różne dla różnych substancji.
Jeśli wasi uczniowie mają przekonania pochodzące z wniosków z ich własnych obserwacji, będą mieli dobre podstawy do nauki krystalografii.
***
Kryształ danej substancji lub materiału ma płaskie ściany usytuowane względem siebie zawsze pod tymi samymi kątami i posiada inne właściwości związane z kierunkami, gdyż jest zbudowany z atomów, jonów lub cząsteczek ułożonych w bardzo uporządkowany sposób. To uporządkowanie struktury występuje w niemal całym stanie stałym, choć niektóre substancje wykazują wyższe uporządkowanie niż inne. Nawet w drewnie cząsteczki są dobrze ułożone równolegle do włókien, choć nie ma już tak dobrego uporządkowania pomiędzy włóknami. Czy w takim razie drewno jest kryształem? Ono nie tworzy płaskich ścian. Niektórzy krystalografowie (ludzie, którzy badają kryształy) mogliby powiedzieć, że te włókna są kryształami; inni, że nie.
Substancja zbudowana z kryształów ma nazwę substancji krystalicznej. Czasami, aby wskazać, że substancja składa się z wielu kryształów, używamy nazwy substancja polikrystaliczna. W monokrysztale uporządkowanie rzędów atomów nie jest przerwane i nie zmienia kierunku. Kiedy dwa kryształy zbliżają się do siebie w trakcie wzrostu, granica między nimi ukazuje miejsce, gdzie kierunek uporządkowania jednego kryształu tworzy kąt z kierunkiem uporządkowania drugiego z nich. Zasugerujmy w tym szkicu płytkę z czterech kryształów z takimi granicami wzrostu. Linie ciągłe przedstawiają granice pomiędzy kryształami (nazywane czasami granicami ziaren). Linie przerywane prezentują warstwy atomów, jonów lub cząsteczek.
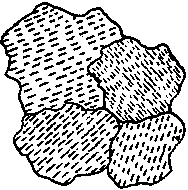
Znamy wiele substancji zbudowanych z dobrze uporządkowanych kryształów, które nie ukazują błyszczących ścian, gdyż sąsiadujące kryształy rosły tworząc między sobą nieregularne granice. Niemal wszystkie skały są zbudowane z takich kryształów i często można w nich rozróżnić różne rodzaje uczestniczących kryształów. Przedmioty metalowe są zbudowane z przerastających się kryształów. Czasem można dojrzeć granice między nimi , na przykład w powłokach cynkowych na galwanizowanym żelazie stosowanym do produkcji wiader, czerpaków i pojemników na śmieci. Niekiedy mosiężne klamki u drzwi ukazują granice między kryształami, które tworzą stop.

Substancja, w której atomy, jony lub cząsteczki nie są ułożone w uporządkowane szeregi, nazywa się szkłem. Dobrze znanym przykładem jest szkło okienne. Szkło wulkaniczne i niektóre popioły wulkaniczne to także szkliwa – nie kryształy. Pewien rodzaj szkliwa przedstawiają również cukierki, często z orzechami wewnątrz. Robi się je przez bardzo szybkie ochłodzenie stopionego cukru, tak, że kryształy nie mają czasu powstać i płyn twardnieje uniemożliwiając cząsteczkom uporządkowanie. To sugeruje, że inne szkła mogą powstawać przez szybkie chłodzenie. Jest tak w przypadku szkieł wulkanicznych, a także niektórych szkieł otrzymanych technicznie, chociaż producenci szkła opanowali technikę tworzenia płynnych mieszanin, które stygnąc powoli nie tworzą kryształów. W niektórych bardzo starych szkłach, wyprodukowanych zanim dobrze opanowano technikę ich produkcji, zaczynają rosnąć kryształy w wyniku powolnej migracji atomów do uprzywilejowanych położeń wyznaczonych przez wzajemne przyciąganie jonów. Nie ma bardzo starych szkieł wulkanicznych, z punktu widzenia geologii. W ciągu setek tysięcy lat atomy miały dość czasu, aby uporządkować się i utworzyć kryształy.
Młodzi ludzie najlepiej się uczą gdy coś robią, a nie gdy się do nich mówi. Najlepszy sposób dla dziecka to nauka o kryształach przez doświadczenie, a nie przez mówienie im o kryształach. Pozwólcie im obserwować, zachwycać się i zadawać pytania. Wtedy może będziemy mogli im pomóc poszukać odpowiedzi na nie. Nie próbujmy definiować słowa kryształ zanim nie przeprowadzimy pewnych doświadczeń z kryształami. To jest podstawą, że Ty, nauczyciel, będziesz wykonywał te doświadczenia i w ten sposób będziesz się cieszył z odkryć razem ze swymi uczniami.
Reszta tego podręcznika będzie pisana jako pomoc dla uczniów. Jeśli uczy czegoś, co już znasz, pamiętaj, że został on napisany dla wszystkich szkół w każdym zakątku Świata.
WYPOSAŻENIE I MATERIAŁY
A. Podstawowe
| Materiały | i sprzęt |
|---|---|
| Sól (sól kuchenna, sól kamienna, chlorek sodu, NaCl) | filiżanka, szklanka lub inny pojemnik |
| Cukier (sacharoza, C12H22O11) | Cylinder miarowy (8 uncji; około 235 ml) |
| Łyżeczka | |
|
|
Nitka lub cienki sznure |
B. Pożądane
| Materiały | i wyposażenie |
|---|---|
| Boraks (Na2B4O7.7H2O) | Szkło powiększające |
| Ałun (ałun ammoniowy, NH4Al(SO4)2.12 H2O) | Szczypczyki lub kleszcze |
| lub Ałun potasowy (KAl(SO4)2.12H2O) | Szklane płytki mikroskopowe, Spód odwróconej szklanki może być użyty |
| Siarczan miedzi (niebieski, CuSO4.5H2O) | Świeca lub inny płomień. Źródło ciepła do gotowania wody |
| Siarczan magnezu (MgSO4.7H2O) | Lodówka lub temperatura poniżej 0 stopni Celsjusza |
| Salol (salicylan fenylu, HOC6H4COOC6H5) | Dwa kawałki folii polaryzującej, takiej jak Polaroid |
| Bizmut (Bi) | |
| Naftalen (drobne płatki, C10H8) |
KRYSZTAŁY W SZKOLE I W DOMU
A. Wzrost kryształów z roztworu
1.SÓL (SÓL KUCHENNA, SÓL KAMIENNA, CHLOREK SODU, NACL)
Zaczniemy od soli, gdyż każdy ją posiada. W czasie, gdy przebiega doświadczenie z solą, możesz gromadzić materiały do dalszych doświadczeń.
a. HODOWLA KRYSZTAŁÓW I OBSERWACJA ICH WZROSTU
Wsyp 3 łyżeczki soli do 1/3 filiżanki wody. [*] Wymieszaj dobrze. Większość soli rozpuści się tworząc roztwór soli w wodzie, ale trochę pozostanie na dnie pojemnika, a roztwór może być mętny. (Niektórzy producenci soli powlekają ziarna nieszkodliwymi nierozpuszczalnymi substancjami, aby nie sklejały się przy wilgotnej pogodzie. Aby usunąć je, jak i pozostałość nierozpuszczonej soli z roztworu, postępujemy następująco). Pozostaw mieszaninę na noc. Następnego ranka roztwór będzie przeźroczysty. Przelej czysty roztwór do płytkiej filiżanki lub szklanki uważając, aby nie poruszyć osadu z dna naczynia. Ta procedura oddzielania cieczy od materiału stałego wprost przez wylewanie cieczy znad stałej masy nazywa się dekantacją.
Usuń stały materiał. Klarowny roztwór pozostaw nieprzykryty na kilka dni. Aby ochronić go od kurzu; można nad nim umieścić odwrócone pudło.
Dana ilość rozpuszczalnika, takiego jak woda, może przyjąć do roztworu tylko pewną ilość poszczególnej substancji. Kiedy już ta ilość jest w roztworze, nazywamy go roztworem nasyconym. Jeśli zawiera mniej, niż tę ilość, nazywamy roztworem nienasyconym. W pewnych przypadkach substancje potrzebują zarodka – malutkiego kawałka kryształu tego samego rodzaju – aby zapoczątkować wzrost kryształu z roztworu. W takich przypadkach, gdy stoi nasycony roztwór i rozpuszczalnik paruje, roztwór może stać się przesycony, zawierając więcej substancji, niż gdyby kontaktował się z materiałem krystalicznym substancji, która jest w roztworze. W takich przypadkach dodanie najmniejszego kawałka kryształu (substancji rozpuszczonej) spowoduje wypadnięcie z roztworu i osadzenie na dnie zlewki nadmiaru substancji.
Kiedy pierwsze cząstki stałe pojawią się na dnie twojego roztworu soli, obserwuj je przy pomocy szkła powiększającego (lupy). Zwróć uwagę na jeden obiekt i obserwuj codziennie jego zmianę. Jeśli zlewka zawierająca roztwór jest szklana, możesz umieścić ją na kartce papieru, na której zaznaczone kółko pomoże ci znaleźć cząstkę, którą obserwujesz.(Biały szron może powstawać na brzegu naczynia, gdy odparowywanie jest szybkie. Będziemy o tym mówili później.) Silne światło z boku może ułatwić ci obserwacje.
Cząstki stopniowo wyrastające z roztworu to kryształy soli. Jeśli będziesz obserwował wczesne stadia ich powstawania, stwierdzisz, że mają kształt kwadratów. Jeśli spojrzysz na nie z boku, dostrzeżesz, że także są kwadratowe lub prostokątne. Ich boki są nawzajem ułożone dokładnie pod kątem prostym i pozostają takie przy wzroście kryształu.
Pomyśl o tym! Z tego bezkształtnego roztworu powstają doskonale uformowane stałe postaci, gdy odparowujesz roztwór w Hiszpanii, czy na Syberii, w Afryce, Ameryce, czy w Australii, w łodzi podwodnej, czy w samolocie. Jak widać, ciało stałe, które powstaje z roztworu soli tworzy małe kryształy z błyszczącymi płaskimi ścianami usytuowanymi pod kątami prostymi. Jak to się dzieje według ciebie?
Wyjmij jeden z małych kryształów z naczynia przy pomocy szczypczyków (pincety) jeśli je posiadasz i osusz. Możesz go włożyć do pudełka i przechowywać. Nie będzie się on zmieniał, jeśli nie będzie zbyt dużo wilgoci w powietrzu. Przy nadzwyczaj wysokiej wilgotności woda z powietrza może zbierać się na krysztale i rozpuszczać go. Kryształy pozostające w pojemniku rosną nadal, gdyż w trakcie odparowywania wody sól rozpuszczona ubywa z roztworu i osiada na ściankach kryształów, powiększając je. Dodawana jest warstwa po warstwie, jak warstwy obrazka na pudełku, każda płaska ściana rośnie pozostając dokładnie pod kątami prostymi do pozostałych ścian.
Co się dzieje, kiedy dwa kryształy, które rosną obok siebie, spotkają się? Obserwuj uważnie. Najczęściej one rosną razem, nieregularnie, podczas gdy ich piękne płaskie ścianki, które nie stykają się ze sobą, kontynuują regularny wzrost wokół wolnych krawędzi, które się nie stykają ze sobą. Kiedy już rosły przez jakiś czas razem, wyjmij je pincetą. Czy możesz powiedzieć, gdzie kończy się jeden kryształ, a zaczyna drugi? W niektórych przypadkach jest to łatwe, w innych nie. Czy możesz je rozdzielić od siebie?
Ponieważ twój roztwór paruje nadal, wiele kryształów zrasta się na dnie pojemnika. Na bokach naczynia powstaje biała skorupa takich samych kryształów, ale bardzo małych. Gdzie parowanie było bardzo szybkie, wiele kryształów zaczęło rosnąć równocześnie, szybko się spotkały tak, że żaden nie mógł urosnąć większy.
W bardzo małych przestrzeniach między kryształami i pomiędzy tą skorupą a ścianami pojemnika działanie kapilarne powoduje podnoszenie się roztworu do góry wzdłuż brzegów naczynia, skąd on szybko paruje powiększając skorupę.
Jak mógłbyś wyhodować większy kryształ, który miałby doskonały kształt, gdyż nie stykałby się z sąsiednimi kryształami? Spróbuj odpowiedzieć, zanim zaczniesz czytać dalej.
Są tu dwie metody do wypróbowania:
1. Ponieważ szybkie parowanie powodowało, że równocześnie i blisko siebie zaczynało rosnąć wiele kryształów, może przez zapobieganie szybkiemu parowaniu moglibyśmy spowodować, że zaczęłoby rosnąć mniej kryształów i w większych odległościach. Moglibyśmy nakryć pojemnik pokrywką – nie zaciśniętą, aby nie zahamować zupełnie parowania, ale bardziej skuteczną niż odwrócone pudło. Kartkę papieru lub kawałek płótna można przymocować do wierzchu pojemnika taśmą gumową, co umożliwi powolne parowanie.
2. Możemy wyjąć jeden dobry mały kryształ, przenieść roztwór nasycony do innego pojemnika i wrzucić tam nasz kryształ. Być może tylko on jeden będzie rósł z tego roztworu. Kryształ wykorzystany w ten sposób nazywamy kryształem zarodkowym (zarodkiem). (Pamiętaj, że roztwór przylegający do wyciąganego kryształu, do pincety lub twoich palców, jest nasycony. Gdy paruje, szybko mogą powstać małe kryształy tworzące dodatkowe zarodki, które mogą konkurować o materiał z tym kryształem, który przeznaczyłeś do hodowli. Dlatego powinieneś szybko osuszyć wyjęty kryształ ręcznikiem papierowym, umyć i powycierać pincetę i palce.)
Gdy kryształ rośnie pozostając na powierzchni, część bliska powierzchni jest pozbawiona dopływu materiału i nie może się rozwijać. Aby umożliwić kryształowi wzrost we wszystkich kierunkach, musimy zawiesić go na nitce w roztworze. Nie jest łatwo zawiązać nitkę wokół małego kryształu. Alternatywna metoda to przyklejenie kryształu do nitki przy pomocy odrobiny cementu do klejenia talerzy. Pozostaw do wyschnięcia przez noc tak przyklejony kryształ, zanim umieścisz go w roztworze nasyconym.
b. CO ROBIĆ Z KRYSZTAŁAMI
1. Można urządzić (przy pomocy pincety) wystawę szeregu kryształów w różnych stadiach wzrostu, mocując je z pomocą odrobiny kleju na ciemnej lub czarnej kartce papieru. Kolejność od małego do dużego pokaże jak kryształy zachowują ten sam kształt w trakcie wzrostu.
Nie wybieraj kryształów zrośniętych, gdyż utrudnia to obserwację kształtów kryształów.
 Dwa kryształy
Dwa kryształy
2.Rozbij kryształ. Uderz kryształ lekko małym młotkiem lub ciężką rączką noża , śrubokrętem lub spodem łyżki. Kryształ popęka wzdłuż płaszczyzn równoległych do płaskich ścian, którymi jest otoczony.
 One popękają na.....
One popękają na.....
One mogą być rozbite na jeszcze mniejsze kawałki posiadające nadal płaskie ścianki (które błyszczą w silnym świetle) równoległe do pierwszych. Mogą być rozbite zupełnie i ich powierzchnie będą nadal nawzajem równoległe.
Ta tendencja kryształu do pękania wzdłuż płaskich powierzchni o określonym położeniu nazywa się łupliwością. Nie wszystkie kryształy wykazują łupliwość. Niektóre przełamują się jak kawałek szkła (przełom muszlowy).
W soli kamiennej płaszczyzny łupliwości są równoległe do ścian wzrostu, ścian, które tworzą zewnętrzne płaszczyzny w trakcie wzrostu. W kryształach niektórych innych substancji płaszczyzny łupliwości nie są równoległe do płaszczyzn wzrostu.
Co stanowi o tym, że kryształy chlorku sodu rosną w kształcie prostokątnym i ściany w nich są nawzajem prostopadłe? Krystalografowie zastanawiali się nad tym przez wiele lat. Dopiero w dwudziestym wieku zastosowanie promieni rentgenowskich umożliwiło zbadanie jak atomy, jony i cząsteczki układają się w kryształach w trakcie ich wzrostu, dlaczego wykazują łupliwość i wiele innych właściwości. Promienie rentgenowskie nie rzucają cieni atomów jak to jest na zdjęciach rentgenowskich kości człowieka. Atomy są zbyt małe. Promienie rentgenowskie są rozpraszane przez atomy i przez badanie kierunków w jakich są te promienie ugięte, krystalografowie poznają jak są zbudowane kryształy.
Stwierdzono, że w chlorku sodu, zwykłej soli kuchennej, jony sodu i chloru ułożone są naprzemian jak na rysunku.

Trzeba wziąć 1017 bloków jak ten, aby utworzyć jedno ziarno sześcianu soli kamiennej o wymiarach 1 mm w każdym kierunku. Jest to 100 000 000 000 000 000, to znaczy sto milionów razy tysiąc milionów. Możesz oczekiwać, że takie uporządkowanie utworzy kryształy o kątach prostych. Możesz także oczekiwać, że kryształy będą się łupały najłatwiej wzdłuż tych warstw jonów sodowych i chlorowych.
Każdy kryształ ma własne, charakterystyczne ułożenie atomów, jonów lub cząsteczek, co decyduje o kształcie w jakim on rośnie i o jego innych właściwościach.
3.Zachowaj kilka najlepszych kryształów w małym pudełku, dzbanku lub kopercie do wykorzystania w dalszych doświadczeniach,. (Patrz doświadczenia ze światłem spolaryzowanym. Rozdział III – D)
4.Połóż kryształ na szkiełku mikroskopowym lub innej czystej powierzchni i umieść na nim dużą kroplę wody, obserwując przez szkło powiększające (lupę) jak się rozpuszcza w wodzie. Narożniki zaokrąglają się najszybciej, gdyż rozpuszczalnik działa na trzy otaczające je ściany. Krawędzie zaokrąglają się nieco wolniej, gdyż mają tylko dwie ściany stykające się z rozpuszczalnikiem. Jeśli kryształ został uratowany zanim rozpuścił się kompletnie, osuszony ręcznikiem papierowym i znów umieszczony w roztworze nasyconym soli, zaczyna znów rosnąć zapełniając krawędzie i narożniki i na nowo uzyska swój pierwotny kształt!
5. Możesz użyć jednego z twoich kryształów jako zarodka, aby wyhodować większy kryształ z roztworu nasyconego tej samej substancji, ale lepsze do tego celu są mniejsze kryształy.
6.Użyj twoich kryształów jako materiału do ponownej krystalizacji. Jest to teraz czysta sól bez żadnych nierozpuszczalnych powłok.
c. NAUKA Z TEGO ROZDZIAŁU
Ważną nauką do przyswojenia z tego rozdziału jest to, że kryształ rośnie przez nakładanie nań soli z wodnego roztworu soli, który otacza go i że on rośnie z płaskimi błyszczącymi ścianami usytuowanymi prostopadle jedna do drugiej pod warunkiem, że ich wzrostowi nic nie przeszkadza. Fakt, że te kryształy wykazują łupliwość, ukazuje że w krysztale nie każdy kierunek jest identyczny. Rodzaj i uporządkowanie atomów, jonów lub cząsteczek w krysztale determinuje jego kształt i inne właściwości.
Jako metodę rozdzielania cieczy od ciała stałego zastosowano dekantację. Jako metodę hodowania większych monokryształów zastosowano zarodkowanie.
Obserwując powstawanie białej skorupy na brzegach pojemnika z roztworem, rosnącej w wyniku podnoszenia się roztworu siłami kapilarnymi, stwierdzono, że kryształy powstałe z gęsto upakowanych zarodków, nie mogą wyrosnąć jako duże monokryształy.
Zaobserwowano sposób w jaki następuje rozpuszczanie kryształu posiadającego kształt sześcianu.
2. BORAKS (NA2B4O7.10H2O) W WODZIE
Chociaż trzecia substancja, cukier, jest bardziej dostępny niż boraks, boraks umieszczono jako drugi, ponieważ tworzy on piękne kryształy tak szybko. Boraks jest używany jako środek czyszczący, do prania odzieży i sprzedawany jest w papierowych pudełkach jako proszek mydlany. Jest szkodliwy, gdyby go połknąć.
Boraks jest dużo lepiej rozpuszczalny w gorącej wodzie niż w zimnej. Nie jest to ogólna reguła. Na przykład sól kamienna jest niemal tak samo rozpuszczalna w gorącej wodzie jak w zimnej.
a. HODOWLA KRYSZTAŁÓW I OBSERWACJA ICH WZROSTU
Dodaj łyżeczkę boraksu do ½ filiżanki bardzo gorącej wody i mieszaj aż do kompletnego rozpuszczenia boraksu. Po ochłodzeniu roztworu wyrośnie wiele pięknych małych kryształów.
b. CO ROBIĆ Z KRYSZTAŁAMI
Działania zalecane przy otrzymywaniu kryształów chlorku sodu (soli kuchennej) są także odpowiednie dla boraksu. Można urządzić podobną wystawę stadiów wzrostu. Można przeprowadzić próby łupliwości. Jeden kryształ można wyjąć z roztworu, osuszyć ręcznikiem papierowym, przywiązać nitką i w charakterze zarodka zawiesić go w roztworze nasyconym. Roztwór, z którym stykają się rosnące kryształy musi być z całą pewnością nasycony. Inaczej kryształy ulegną rozpuszczeniu. Dlatego, jeśli roztwór jest przeniesiony do innego pojemnika w tej samej temperaturze (uwolniony z małych kryształów rosnących w nim), będzie odkładał boraks na zarodku boraksowym zawieszonym w nim.
Najlepiej jest zawiesić zarodek blisko dna pojemnika. Przyczyna tego jest następująca. Gęstość niemal każdego roztworu nasyconego jest większa niż roztworu nienasyconego. Gdy boraks osadza się na krysztale, roztwór traci gęstość i unosi się w górę. Gęstszy, nasycony roztwór ( ważący więcej na jednostkę objętości) płynie niżej zajmując miejsce lżejszego i dostarcza więcej materiału do zarodka. Jeśli zawieszony kryształ znajduje się blisko powierzchni roztworu, jego górną część otacza mniej gęsty, nienasycony roztwór. Oczywiście, na samej powierzchni, gdzie roztwór styka się z powietrzem, parowanie powoduje krystalizację. Często powstają tam kryształy, ale mogą rozwijać się tylko z jednej strony i dlatego zawsze są zdeformowane.
Porównaj kształt kryształów boraksu z kryształami soli kamiennej.
Obserwuj bardzo małe kryształy soli kamiennej i bardzo małe kryształy boraksu pomiędzy skrzyżowanymi polaryzatorami (patrz rozdział III – D) stosując powiększenie. Wynik może być mniej oczywisty przy dużych kryształach z błyszczącymi ścianami lub inkluzjami, które odbijają światło.
Cząsteczki wody znajdują się pomiędzy niewidzialnymi cząstkami, z których zbudowane są kryształy boraksu. Jeśli kryształy boraksu pozostawić na dłużej w gorącym, suchym miejscu, część wody ujdzie do powietrza. Ta część kryształu, która utraciła wodę, zamienia się w proszek. Małe cząstki proszku rozpraszają światło i dlatego wyglądają na białe. Ten proces utraty wody nazywa się dehydratacją (odwodnieniem).
c. NAUKA Z TEGO ROZDZIAŁU
Niektóre kryształy, jak boraks, wykształcają ściany, które nie spotykają się pod kątami prostymi. Boraks i sól kamienna mają różne kształty. Boraks i sól kamienna zachowują się w różny sposób wobec światła, jak wskazuje ich wygląd między skrzyżowanymi polaryzatorami. Za pomocą właściwości, które zaobserwowano, można odróżnić dwie substancje. Różnią się one rozpuszczalnością, kształtem kryształów, łupliwością i zachowaniem względem światła. Jasne jest więc, że kiedy boraks opuszcza roztwór, buduje kryształy w inny sposób niż sól kamienna w trakcie wyrastania z roztworu.
3. CUKIER (SACHAROZA), C12H22O11) W WODZIE
a. HODOWLA KRYSZTAŁÓW I OBSERWACJA ICH WZROSTU
Trudno jest wyhodować dobre kryształy cukru. Cukier w wodzie tworzy bardzo lepką ciecz (syrop) i cząsteczki cukru nie mogą szybko migrować przez nią, aby połączyć się z innymi cząsteczkami cukru w uporządkowany sposób, który nazywamy kryształem.
Tajemnicą powodzenia jest utrzymywanie roztworu na tyle gorącego, aby zapewnić ruchliwość cząsteczek, ale równocześnie uniknąć szybkiego parowania z powierzchni, co mogłoby spowodować tworzenie skorupy cukrowej. Aby osiągnąć te dwa cele, postępuj następująco.
Ogrzewaj powoli, stale mieszając, filiżankę cukru z połową filiżanki wody, aż wszystek cukier się rozpuści i roztwór stanie się przeźroczysty. Umieść roztwór w słoiku po dżemie lub galaretce i nałóż pokrywkę, ale nie zakręcaj jej ściśle. Słoik musi być gorący przez wiele dni.
Można go umieścić nad mikropalnikiem w piecu gazowym. Woda parująca z powierzchni kondensuje się na wieczku i krople spadają na powierzchnię roztworu, co zapobiega tworzeniu skorupy. Nieco wody uchodzi, ponieważ wieczko nie jest mocno zamknięte. W końcu kryształy zaczynają rosnąć przyjmując piękne kształty charakterystyczne dla cukru. Wzrost przebiega powoli przez długi czas.
Roztwór cukru posiada ciekawą właściwość, skręca płaszczyznę światła spolaryzowanego ( patrz rozdział III-D. To skręcenie jest różne dla różnych barw światła. Gdy umieścisz słoik z roztworem cukru pomiędzy skrzyżowanymi polaryzatorami i patrzysz przezeń i polaryzatory w białym świetle, zauważysz, że nie jest czarny, jak roztwór soli kamiennej, ale barwny. Kiedy obrócisz jeden z polaryzatorów ( w jego własnej płaszczyźnie, jak wskazówki zegara), pozostawiając drugi polaryzator nieruchomy, barwa się zmieni.
b. CO ROBIĆ Z KRYSZTAŁAMI
Wszystkie zalecenia podane w rozdziałach o soli kamiennej i boraksie mają zastosowanie również tutaj. Dodatkowo możesz teraz porównać kształty kryształów cukru z kształtami kryształów boraksu i soli kamiennej.
c. NAUKA Z TEGO ROZDZIAŁU
Kryształy cukru różnią się kształtem i łatwością wzrostu od kryształów soli kuchennej, innej substancji obecnej na naszym stole. One różnią się także kształtem i łatwością wzrostu od kryształów boraksu. Kiedy cukier wypada z roztworu, musi on budować kryształ w inny sposób niż kryształy soli kamiennej i boraksu. Każda substancja ma własny sposób porządkowania cząstek substancji, aby utworzyć kryształ.
Cząstki stanowiące kryształ muszą mieć swobodę poruszania, jeśli mają się łączyć celem tworzenia kryształu. Roztwór cukru jest tak lepki (syrop), tak spowalnia ruch cząsteczek, że trudniej jest wyhodować kryształy cukru niż kryształy soli kamiennej lub boraksu.
Roztwór wodny cukru, w przeciwieństwie do roztworu soli kamiennej lub boraksu, skręca płaszczyznę światła spolaryzowanego ( patrz rozdział 3-D).
4. AŁUN AMMONIOWY [NH4Al(SO4)2.12H2O] LUB AŁUN POTASOWY [KAl(SO4)2.12H2O] W WODZIE
Kryształy ałunu są łatwiejsze w hodowli niż kryształy soli kamiennej i o wiele łatwiejsze niż kryształy cukru. Mają one błyszczące ściany i małe kryształy „świecą” powabnie. Sproszkowany ałun jest do kupienia w drogeriach i aptekach. Jest on stosowany jako środek ściągający i do zmniejszania krwawienia z małych zacięć.
a. HODOWLA KRYSZTAŁÓW I OBSERWACJA ICH WZROSTU
Umieść 4 łyżeczki sproszkowanego ałunu w pół filiżanki gorącej wody. Mieszaj, aby wspomóc rozpuszczanie. Po pewnym czasie cały proszek przejdzie do roztworu, który wówczas będzie przeźroczysty.
Aby zabezpieczyć przed kurzem, nakryj pojemnik lekkim nakryciem jak kartka papieru. W trakcie odparowywania wody pojawią się piękne kryształy ałunu.
Starannie obserwuj kryształy i porównaj ich kształt z kryształami innych substancji. Są one jaśniejsze czy mniej jasne niż kryształy soli kamiennej? Zwróć uwagę, że kryształy ałunu,
jak kryształy boraksu, zawierają wodę (H2O) wchodzącą w ich skład. Może być ciekawe porównanie wyglądu i łatwości wzrostu z roztworu wodnego kryształów, które zawierają cząsteczki wody w swym składzie i tych, które nie zawierają wody.
b. CO ROBIĆ Z KRYSZTAŁAMI
1. Przygotuj wystawę według kolejności wzrostu kryształów, jak w przypadku soli kamiennej.
2. Rozbij je. Odkryjesz, że w przeciwieństwie do soli kamiennej, ale tak jak cukier , ałun nie ma płaszczyzn łupliwości.
3. Zachowaj kilka kryształów w pudełku lub kopercie, właściwie oznakowanej, do wykorzystania w dalszych doświadczeniach.
4. Rozpuść częściowo i poddaj ponownie wzrostowi kryształ ałunu, jak w doświadczeniu z solą kamienną.
5. Zawieś doskonały mały zarodek kryształu ałunu w nasyconym roztworze ałunu i hoduj piękny okaz.
6.Patrz na kryształ ałunu między skrzyżowanymi polaryzatorami (rozdział III – D2).
c. NAUKA Z TEGO ROZDZIAŁU
Kryształy ałunu różnią się od kryształów soli kamiennej i kryształów cukru pod wieloma względami. Szybciej rosną i osiągają duże rozmiary. Posiadają kształty inne niż kryształy soli kamiennej i cukru. Tak jak kryształy cukru, ale przeciwnie niż kryształy soli, nie wykazują łupliwości – przełamują się nieregularnie. Tak jak kryształy soli kamiennej, ale nie jak kryształy boraksu i cukru, są zaciemnione pomiędzy skrzyżowanymi polaryzatorami.
5. SIARCZAN MIEDZI (NIEBIESKI WITRIOL, CUSO4.5H2O) W WODZIE
TRUJĄCY
Możesz otrzymać siarczan miedzi w drogerii lub aptece. Jest on używany w niektórych basenach pływackich dla zapobiegania wzrostowi glonów, ale jest do pewnego stopnia trujący. Uczniowie nie powinni wynosić go do domu. Powinni myć starannie ręce po dotykaniu proszku, roztworu lub kryształów. (Proszek składa się również z malutkich kryształów, ale bezwodnego siarczanu miedzi, bez wody wchodzącej w skład kryształów.)
a. HODOWLA KRYSZTAŁÓW I OBSERWACJA ICH WZROSTU
Umieść 4 łyżeczki proszku siarczanu miedzi w pół filiżanki gorącej wody i mieszaj, aż zawartość się rozpuści. W trakcie parowania roztworu na brzegach i nad brzegami pojemnika pojawi się skorupa. Siarczan miedzi jest nawet gorszy pod tym względem niż roztwór soli kamiennej, dlatego dobrze jest postawić naczynie na talerzyku lub innej podstawce.
Po odparowaniu odpowiedniej części wody z roztworu zaczną rosnąć błyszczące niebieskie kryształy. Zwróć uwagę na ich kształty i obserwuj codziennie ich wzrost.
Można wykonać piękne doświadczenie mieszając proszek ałunu i proszek siarczanu miedzi i rozpuszczając mieszaninę ( na przykład po 2 łyżeczki każdego z nich w pół filiżanki wody). Zobaczymy, że kryształy ałunu rosną jak przedtem , bezbarwne i posiadające własny kształt; kryształy siarczanu miedzi rosną również jak przedtem, błyszczące, niebieskie i zachowujące własny kształt. Mogą się one spotykać i stykać, ale nie mieszają się. Uporządkowanie w ałunie nie jest takie samo jak uporządkowanie w siarczanie miedzi i każda substancja buduje swój własny rodzaj kryształów.
b. CO ROBIĆ Z KRYSZTAŁAMI
PAMIĘTAJ, ŻE SIARCZAN MIEDZI JEST TRUJĄCY. Nie mogą się z nim stykać małe dzieci. Starszym dzieciom należy za każdym razem przypominać o myciu rąk po pracy z tą substancją.
1. Kryształy różnej wielkości można uszeregować jak poprzednio dla ukazania etapów ich wzrostu.
2. Zbadaj ich kształty i porównaj je z kształtami kryształów ałunu, cukru, boraksu i soli kamiennej.
3. Spróbuj obrysować linie brzegowe każdego rodzaju kryształu wyhodowanego dotychczas. Rysunek pomaga obserwacji.
4. Spróbuj rozłupać kryształ. (Kryształ siarczanu miedzi nie wykazuje łupliwości).
5. Po przetrzymywaniu przez długi czas kryształów siarczanu miedzi w gorącym, suchym miejscu, mogą się one odwodnić, podobnie jak ałun lub boraks.
6.Skorupa powstająca na brzegu zlewki zawiera głównie bezwodną postać siarczanu miedzi. Można ją zebrać i rozpuścić ponownie, jak to zrobiono na początku z bezwodnym proszkiem.
c. NAUKA Z TEGO ROZDZIAŁU
Znów porównanie nowych kryształów z wyhodowanymi wcześniej wykazuje, że każda substancja ma swój własny kształt i właściwości, a tym razem została dodana nowa właściwość – barwa.
Jeśli spróbujemy zmieszać ałun i siarczan miedzi, dokonamy dodatkowej obserwacji, że każda substancja dodaje do swego kryształu tylko właściwe nowe cząstki i nie przyjmuje innych cząstek obecnych w roztworze, nie należących do struktury danego kryształu.
6. SIARCZAN MAGNEZU (SÓL Z EPSOM, MGSO4.7H2O) W WODZIE
Siarczan magnezu jest sprzedawany jako środek przeczyszczający, a także do mokrych okładów przy stłuczeniach, zwichnięciach i ukłuciach owadów. Jest sprzedawany w niemal wszystkich drogeriach i aptekach.
a. HODOWLA KRYSZTAŁÓW I ICH OBSERWACJA
Siarczan magnezu bardzo dobrze rozpuszcza się w wodzie. Możesz rozpuścić około 6 łyżeczek w jednej czwartej filiżanki gorącej wody. Mieszaj roztwór przez kilka minut. Jeśli nie rozpuściła się cała sól, dodaj bardzo małą ilość wody i mieszaj, aż roztwór stanie się przeźroczysty.
Kryształy rosną w postaci długich igieł – inaczej niż kryształy soli kamiennej, boraksu, cukru, ałunu, lub siarczanu miedzi. Ponieważ substancja jest tak łatwo rozpuszczalna, jedna kropla roztworu wystarczy do utworzenia grupy cienkich kryształów w trakcie parowania. Jeśli kroplę umieścić na powierzchni nie absorbującej wody, jak szkło, powierzchnia kropli pokryje się kryształami i dalsze parowanie zostanie zahamowane. Lepiej umieścić kroplę na powierzchni absorbującej wodę jak tektura lub papier. Szczególną korzyść przyniesie obserwacja małej grupy kryształów przez szkło powiększające.
b. CO ROBIĆ Z KRYSZTAŁAMI
Igiełkowaty kształt małych kryształów siarczanu magnezu ułatwia uwiązanie ich na nitce. Mała igła siarczanu magnezu, zawieszona w jego nasyconym roztworze urośnie jako ładny kryształ w kształcie słupka.
Siarczan magnezu odwadnia się szybciej niż inne zawierające wodę sole, które krystalizowałeś. Kryształy zachowują kształt, lecz ich powierzchnia wygląda jak pomalowana białą farbą. Możesz zeskrobać odwodnioną warstwę i zobaczyć pod nią przeźroczysty kryształ, który jeszcze nie utracił cząsteczek wody. Możesz się przekonać, że biała substancja potrzebuje tylko wody, aby stać się tym samym co twoje wyhodowane kryształy. Możesz je rozpuścić w niewielkiej ilości wody i pozwolić wodzie parować.
Spośród wszystkich kryształów które hodowałeś, ałun utrzymuje swą wodę najsilniej. Jednakże żaden z nich nie utrzyma wody w ogniu zapałki. Umieść mały kryształ każdej z tych substancji na szkiełku mikroskopowym, albo kawałku metalu jak folia aluminiowa. Umieść płonącą zapałkę pod nią. Każdy kryształ zacznie tracić wodę, która będzie się gotowała żywo w ogniu zapałki. Jeśli przerwiesz ogrzewanie, gdy jest jeszcze woda, powstanie na nowo wiele malutkich kryształów tych substancji. Jednakże, jeśli będziesz prowadził ogrzewanie, aż skończy się wrzenie wody ( to znaczy, gdy wszystka woda zostanie usunięta), pozostanie biała, odwodniona substancja.
c. NAUKA Z TEGO ROZDZIAŁU
Siarczan magnezu jest bardzo dobrze rozpuszczalny w wodzie.
Tak samo jak boraks, ałun i siarczan miedzi, siarczan magnezu jest zbudowany częściowo z wody i może ulec odwodnieniu.
Kiedy substancja bardzo dobrze rozpuszcza się w wodzie, kropla roztworu nasyconego zawiera sporo substancji.
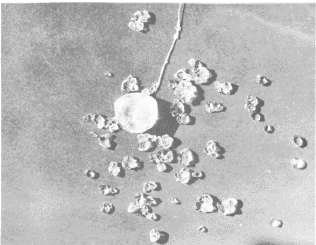
Teraz, kiedy wyhodowałeś wiele różnych rodzajów kryształów, możesz urządzić ich wystawę. Tutaj zaprezentowano zdjęcie kilku kryształów ałunu wyhodowanych dokładnie w taki sposób jak opisano w tym podręczniku.
CO DALEJ?
Jest wiele innych substancji, które mógłbyś rozpuścić w wodzie. Czy wszystkie utworzą kryształy, gdy woda wyparuje? Nie, ale nie możesz być pewny co do sposobu ich zachowania, zanim nie wypróbujesz. „Hipo” (tiosiarczan sodu), używany przez fotografów do utrwalania filmu po jego wywołaniu, tworzy dobre kryształy rosnące z roztworu wodnego. To samo dotyczy soli Rochella. Przepis hodowli dużych kryształów soli Rochella i pomysły wykonywania z nimi ciekawych doświadczeń zawarte są w książce „Crystals and Crystal Growing „ napisanej przez Haldena i Singera. (patrz na listę zalecanej literatury na końcu tego podręcznika).
B. KRYSZTAŁY ZE STOPU (ze stanu stopionego tej samej substancji co kryształy)
1. LÓD (ZESTALONA WODA, H2O)
Lód jest jedną z niewielu substancji, które zmieniają nazwę po stopieniu. Woda jest tak powszechnie spotykaną substancją, że jest użyteczne stosowanie różnych nazw dla różnych stanów, w których ona występuje: lód, śnieg, szron, rosa, deszcz, para, mgła, chmura.
Lód jest jedną z niewielu substancji, które kurczą się, kiedy się topią. Dana masa lodu zajmuje większą przestrzeń niż masa tego lodu stopionego na wodę. Inny sposób wyrażenia tego samego, to powiedzenie, że dana objętość lodu waży mniej niż ta sama objętość wody. Jest tak dlatego, że lód jest mniej gęsty niż woda. Dlatego lód pływa na wodzie. Jeśli woda zamarznie w pojemniku, który nie może się rozszerzyć, pojemnik może pęknąć.
Ponieważ woda zajmuje mniej przestrzeni niż lód, możesz zamienić lód w wodę przez wywarcie ciśnienia. Jest to jedna z przyczyn, dlaczego lód jest tak śliski, gdy staniesz na nim lub jeździsz na łyżwach. Ciśnienie stwarza między tobą a lodem cienką warstwę wody, która działa jak smar.
Możesz zademonstrować zamianę lodu w wodę przez zastosowanie prasy i zamianę wody z powrotem w lód przez obniżenie ciśnienia, za pomocą następującego doświadczenia. Umieść kostkę lodu na odwróconej szklance. Przywiąż dwa końce krótkiej notki do ołówków. Umieść nitkę na wierzchu lodu i ciągnij w dół dwa końce nitki, jak to pokazano na rysunku.
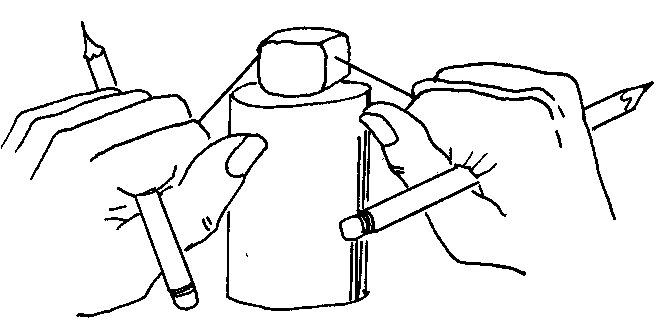
Nitka będzie się poruszała w dół przez lód. Lód topnieje pod nitką, gdy występuje ciśnienie i zamarza na nowo nad nitką, gdzie nie działa już ciśnienie.
a. HODOWLA KRYSZTAŁÓW
Jedna metoda hodowli kryształów lodu, to umieszczenie patelni z wodą w zamrażarce lodówki domowej, lub za drzwiami, gdy na zewnątrz temperatura jest mocno poniżej 0 stopni Celsjusza. W ciągu około 2 godzin (w temperaturze ok. –10 stopni Celsjusza) część wody zamieni się w lód. Niektóre kryształy będą miały długi, cienki kształt i mogą być zrośnięte z innymi kryształami. Wyjmij je z patelni i poddaj badaniu. Dobry sposób znalezienia granicy między zrośniętymi kryształami to oglądanie ich między skrzyżowanymi polaryzatorami (patrz rozdział B poniżej).
Inny sposób hodowli kryształów lodu, to umieszczenie kropli wody na szkiełku mikroskopowym lub na dnie odwróconego kubka albo jakiejkolwiek płaskiej powierzchni i umieszczenie jej w zamrażalniku.
b. CO ROBIĆ Z KRYSZTAŁAMI
Zbadaj je między skrzyżowanymi polaryzatorami, stosując warunki umocowania polaryzatorów zalecane w rozdziale III – D.
Jeśli masz małą kroplę wody zamrożoną na kawałku szkła, możesz je trzymać poziomo między polaryzatorami, oświetloną od spodu i obserwować zmianę barw w miarę jak kryształ staje się coraz cieńszy w trakcie topnienia.
Obracaj szkiełko w jego płaszczyźnie, między polaryzatorami, jak wskazówki zegara. Zauważ, że w niektórych pozycjach kryształy stają się ciemne, a w innych błyszczą. Część, która zachowuje się tak samo w czasie obrotu, należy do jednego monokryształu. Pomiędzy nim i inną częścią zachowującą się inaczej występuje granica. Może znaleźć się część, która jest zaciemniona we wszystkich momentach obrotu. Ta część ma oś optyczną ustawioną w tym kierunku, w którym patrzysz na kryształ.( patrz odsyłacz nr 3, rozdział V.) Jeśli odchylisz szkiełko od płaszczyzny „kierunku obserwacji”, ta część rozjaśni się.
Jeśli masz płytkę lodu znad wody wypełniającej patelnię o grubości około 2 - 3 mm, możesz ujrzeć coś specjalnego między skrzyżowanymi polaryzatorami. Aby nie zamoczyć polaryzatorów, ustaw je pionowo.

Znajdź dużą część płytki lodu, która pozostaje ciemna, gdy ją obracać we własnej płaszczyźnie między skrzyżowanymi polaryzatorami. Utrzymuj ją blisko jednego polaryzatora i zbliż oko jak najbliżej polaryzatora. Zobaczysz czarny krzyż na szarym tle, a jeśli płytka lodu będzie dość cienka, zobaczysz żółty pierścień wokół krzyża, a za nim czerwony pierścień. Jest on znany krystalografom jako figura interferencyjna. (Patrz Odsyłacz nr 3, Rozdział V.)
c. NAUKI Z TEGO ROZDZIAŁU
Kryształy lodu mogą rosnąć ze stopionego lodu (to jest wody).
Granice między kryształami w płytce lodu mogą być wykryte pomiędzy skrzyżowanymi polaryzatorami.
Ponieważ woda jest gęstsza niż lód, lód można zamienić w wodę przez zastosowanie ciśnienia. Jeśli temperatura jest poniżej 0 stopni Celsjusza, woda zamieni się z powrotem w lód, gdy usuniemy ciśnienie. (Zauważ, że lód jak każde ciało stałe, może być zimniejszy niż jego temperatura topnienia. Wielu ludzi ma dziwne przekonanie, że lód występuje zawsze w 0 stopni Celsjusza. Kiedy lód powstaje z wody i jeszcze jest woda wokół niego, jego temperatura wynosi 0 stopni Celsjusza.
2. SALOL (SALICYLAN FENYLU, ESTER FENYLOWY KWASU SALICYLOWEGO, HOC6H4COOC6H5)
Salicylan fenylu jest sprzedawany w drogeriach i sklepach chemicznych. Jest używany jako środek ściągający tkanki. Nie jest rozpuszczalny w czystej wodzie, ale jest rozpuszczalny w alkoholu etylowym. Topi się w temperaturze 42 stopni C.
a. HODOWLA KRYSZTAŁÓW I OBSERWACJA ICH WZROSTU
Umieść nieco proszku salicylanu fenylu na jakiejś powierzchni, która może być ogrzewana od spodu płomieniem zapałki. Najlepsza powierzchnia to szkiełko mikroskopowe lub inny kawałek szkła , ale nawet kawałek folii aluminiowej może służyć do tego celu. Ilość proszku powinna być mała, wielkości ziarna grochu. Ogrzewaj go płomieniem zapałki od spodu, trzymając zapałkę na tyle daleko, aby nie zaczernić szkła sadzą. Zakończ ogrzewanie, jak tylko proszek się stopi.
Możesz oczekiwać, że salol przejdzie ponownie w stan stały jak tylko stop ochłodzi się do 42 stopni C. Nie nastąpi to, aż pojawi się zarodek krystaliczny salolu. Ponieważ proszek salolu złożony jest z małych fragmentów kryształów, małe ziarno proszku może posłużyć jako zarodek do zapoczątkowania krystalizacji, gdy ciecz jest wystarczająco chłodna.
Jeśli dodać zbyt wiele proszku do cieczy, zbyt wiele kryształów zacznie rosnąć równocześnie i zaczną zakłócać nawzajem swój wzrost. Wówczas nie będziesz mógł zobaczyć pięknych prostych krawędzi, które rozwijają się w trakcie niezakłóconego wzrostu kryształów. Kształt, który rozwijają kryształy salicylanu fenylu w trakcie wzrostu, jest podobny do kara w kartach do gry. Jeśli obserwujesz wzrost przez szkło powiększające, możesz dostrzec jak pojawiają się te płytki i rosną, zachowując stale ten sam kształt. Warstwa po warstwie substancji jest dodawana z szybkością tysięcy warstw na sekundę, wszystkie w takim porządku, że boki kryształu są doskonale proste i stale mają te same kąty z sąsiednimi bokami.
Kiedy wzrost zostanie zatrzymany, obserwuj masę kryształów przy pomocy szkła powiększającego. Większość z nich nie ukaże konturów kara, gdyż spotkały w czasie wzrostu sąsiednie kryształy, które rosły wokół nich. Jeśli obrócisz masę kryształów w odpowiedni sposób względem światła, zobaczysz światło odbite od ich doskonale płaskich ścianek. Ściany kryształów, zbudowane z najmniejszych jednostek budowy materii, są najdoskonalej płaskimi powierzchniami osiągalnymi fizycznie – bardziej płaskimi niż jakakolwiek powierzchnia otrzymana przez szlifowanie. Salicylan fenylu można topić i rekrystalizować wielokrotnie.
b. CO ROBIĆ Z KRYSZTAŁAMI
Ponieważ salicylan fenylu nie jest lepki, nie rozkłada się, ani trujący lub szkodliwy dla odzieży, szkiełko mikroskopowe z jego kryształami zamrożonymi na nim można trzymać w kieszeni. Jeśli przygotujesz szkiełko z większą masą kryształów na jednym końcu i mniejszą na drugim, możesz stopić większą masę pozostawiając mniejszą zimną i stałą. Wtedy możesz odłamać mały fragment z mniejszego kawałka i użyć jako zarodka. Zachowaj taki kawałek, aby zademonstrować wzrost kryształów twoim przyjaciołom.
Jeśli przygotujesz cienki film stopionego salicylanu fenylu pomiędzy dwoma szkiełkami mikroskopowymi i ściśniesz je aż do zestalenia zawartości, (te dwa szkiełka zostaną sklejone) możesz zaobserwować jeszcze bardziej interesujące zjawisko. Najpierw obserwuj twoją płytkę „szkło – salol – szkło” między skrzyżowanymi polaryzatorami (patrz rozdział III – D). Obracaj płytkę zgodnie ze wskazówkami zegara pomiędzy polaryzatorami, utrzymując je pod kątem prostym. Jeśli nie widzisz barw w kryształach, warstwa salicylanu fenylu między szkiełkami jest za gruba. Stop jeszcze raz i studź, tym razem ściskając mocniej szkiełka.
Następnie stop nieco salicylanu fenylu w środku szkiełka trójwarstwowego preparatu. Przestań grzać, jak tylko zacznie się topnienie. Inaczej stopi się cała zawartość pomiędzy szkiełkami i rozpadnie się trójwarstwowy preparat. Teraz znów obserwuj preparat pomiędzy skrzyżowanymi polaryzatorami. (UWAGA: film polaryzujący może zostać uszkodzony przez ciepło. Trzymaj je z daleka od gorącej części preparatu. Uchwyt opisany w części III – D pomoże ci w tym) . Część ciekła jest czarna między skrzyżowanymi polaryzatorami, ale otaczające ją kryształy salicylanu fenylu są jasne. Przy pomocy szkła powiększającego obserwuj jasne ostrza kryształów rosnące w ciemnym otoczeniu jak nieuporządkowane, zderzające się cząstki przekształcają ciecz w obszary uporządkowane, tworząc kryształy salicylany fenylu.
c. NAUKA Z TEGO ROZDZIAŁU
Także ogrzewanie może spowodować, że uporządkowane ciało stałe przechodzi w nieuporządkowaną ciecz. Ciecz wygląda jak woda, ale nie jest wodą, gdyż nie gotuje się w cieple płomienia zapałki i przekształca się w materię krystaliczna w temperaturze znacznie wyższej niż woda zamienia się w ciało stałe nazywane lodem.
Kryształ może zachować doskonały kształt i błyszczące ściany w trakcie nakładania się tysięcy warstw niewidzialnych cząstek na sekundę.
Ciekły benzoesan fenylu jest ciemny między skrzyżowanymi polaryzatorami, jak szkło i woda, ale jego kryształy błyszczą między skrzyżowanymi polaryzatorami i ukazują barwy, jeśli kryształy są dość małe.
Ciekły salicylan fenylu nie będzie tworzył kryształów (to znaczy nie będzie zmieniał się w ciało stałe) jeśli nie dostarczymy zarodka krystalicznego, na którym zacznie się proces krystalizacji.
3. BIZMUT (PIERWIASTEK METALICZNY, Bi)
Pierwiastek metaliczny bizmut topi się w temperaturze 271 stopni C. Podobnie jak woda, ma on rzadką właściwość powiększania objętości przy przejściu do stanu stałego (gdy krystalizuje). Możesz otrzymać bizmut z firmy sprzedającej odczynniki chemiczne lub z uniwersyteckiego wydziału chemii.
a. HODOWLA KRYSZTAŁÓW I OBSERWACJA ICH KSZTAŁTÓW
Stop bizmut w otwartej patelni. Gdy się cały stopi, usuń patelnię znad źródła ciepła. W trakcie chłodzenia patelni zaczną powstawać kryształy na jej wewnętrznej powierzchni. Nie możesz ich widzieć, ale przy pomocy dużych szczypców chemicznych możesz je wyczuć pod powierzchnią nieprzeźroczystej cieczy. Wyjmij je z gorącej cieczy za pomocą szczypiec i otrząśnij starannie z cieczy. Powierzchnie kryształów bizmutu mogą mieć wiele małych schodków.
b. CO ROBIĆ Z KRYSZTAŁAMI
Obracaj kryształy tam i z powrotem w jasnych promieniach światła , najlepiej pochodzących z odległego źródła. Zwróć uwagę, że powierzchnie wielu schodków równocześnie odbijają światło. Aby to sprawić, muszą one być nachylone pod tym samym kątem względem promieni światła, to znaczy muszą być do siebie równoległe. Muszą być one zbudowane z warstw elementarnych jednostek budowy kryształu bizmutu nawzajem równoległych i uporządkowanych. To wskazuje, że schodki nie są różnymi kryształami, ale wszystkie należą do tego samego kryształu. W sąsiednim krysztale będzie inny zbiór schodkowanych ścian, które będą odbijały światło pod innym kątem.
Badając kryształy bizmutu możesz dostrzec, że ich powierzchnie mienią się barwami tęczy jak na pawich oczkach i bańkach mydlanych. Pochodzi to z obecności cienkiej warstwy tlenku bizmutu, który często powstaje na powierzchni stygnących kryształów. Jest ona tak cienka, że światło przechodzi przez nią do powierzchni kryształu bizmutu gdzie jest odbijane.
W swej drodze powrotnej spotyka ono światło odbite od powierzchni warstwy tlenku. Dwa promienie światła interferują ze sobą . Gdy to się wydarza, jedna z barw składowych światła białego, które składa się z wszystkich barw tęczy, zostaje wygaszona. Kiedy jedna barwa zostaje odjęta, światło nie jest białe, ale barwne. Dlatego powierzchnie kryształów bizmutu wydają się barwne. Tak samo zachowuje się cienka warstwa oleju na wodzie. To samo dotyczy pawich oczek i baniek mydlanych. Barwy tworzone w ten sposób nazywają się barwami interferencyjnymi.
c. NAUKA Z TEGOO ROZDZIAŁU
Ściana kryształu może być zaburzona przez stopień , a będzie to ten sam kryształ po obu stronach stopnia. Jednakowe ustawienie płaszczyzn dowodzi, że należą one do tego samego kryształu.
Promienie światła białego odbite od dwóch powierzchni cienkich warstw materii mogą interferować i bać światło barwne.
C. KRYSZTAŁY Z PARY (STANU GAZOWEGO TEJ SAMEJ SUBSTANCJI)
1. LÓD
Czasem na dworze lód powstaje bezpośrednio ze stanu pary. Jeśli pogoda jest bardzo zimna i wilgotna, na drzewach może powstawać szron. Drzewa rosnące na dużych wysokościach często pokryte są piórami szronu. Lód może powstawać na bardzo zimnych szkłach okien domowych z pary wodnej znajdującej się w domu.
a. HODOWLA KRYSZTAŁÓW I OBSERWACJA ICH WZROSTU
Jeśli atmosfera w pokoju jest dość wilgotna, możesz spowodować wzrost kryształów lodu z pary wodnej na szklanym lub metalowym pojemniku wypełnionym połamanym lodem i alkoholem (lub połamanym lodem i solą). Od czasu do czasu poruszaj mocno zawartość pojemnika. Kryształy nie będą miały ładnych ścian, ale możesz zobaczyć jak iskrzą małe ścianki, gdy skierujesz mocne światło na oszronioną powierzchnię.
b. CO ROBIĆ Z KRYSZTAŁAMI
Opróżnij szklankę i obserwuj topnienie na niej szronu. Nie powstał on z ciekłej wody; przeszedł bezpośrednio w stan stały ze stanu gazowego. Teraz, po ogrzaniu, przechodzi w stan ciekły. Jeśli pozostawisz na dłużej szklankę lub pojemnik metalowy, woda znów przejdzie w stan gazowy; to znaczy, wyparuje.
c. NAUKA Z TEGO ROZDZIAŁU
Para wodna, która jest wodą w niewidzialnyn stanie gazowym, występuje w powietrzu wokół nas. Można spowodować, aby wystąpiła na bartdzo zimnych powierzchniach jako lód ( a na mniej zimnych jako woda).
2. NAFTALEN (PŁATKI PRZECIWMOLOWE, C10H8)
UWAGA: PALNY
Ta substancja, które była długo używana do chronienia wełnianej odzieży przed molami, nie może być mylona z innymi substancjami produkowanymi ostatnio w tych samych celach (na przykład paradichlorobenzen). Sprzedawany jest zwykle w papierowych opakowaniach, ma postać dużych białych płatków.
a. HODOWLA KRYSZTAŁÓW I OBSERWACJA ICH WZROSTU
JEST ŁATWO PALNY I NIE MOŻNA GO OGRZEWAĆ NAD OTWARTYM PŁOMIENIM
Łatwy sposób hodowli kryształów jest następujący: Umieść trochę płatków naftalenu (pół łyżeczki) na dnie wysokiego szklanego kubka. Na wierzchu kubka umieść pokrywkę, która jest za duża dla niego. Może do tego służyć kawałek folii aluminiowej lub nawet kartka papieru. Nie zaciskaj przykrywki wokół kubka, bo mogłoby to stanowić pułapkę gorących par w kubku. Gdybyś to zrobił, pary mogłyby eksplodować.
Ustaw spód kubka nad zapaloną żarówką lampy. Bardzo szybko ( przy użyciu żarówki 100 – watowej) zobaczysz jak powstają małe kryształy w górnej wewnętrznej części kubka, gdzie gorąca, niewidzialna para naftalenu ochładza się i wzajemne przyciąganie niewidzialnych cząstek łączy je w uporządkowany kryształ naftalenu.
Niektóre z nich tworzą rozgałęzione, pierzaste grupy kryształów, które przypominają szron na szkle szyby okiennej. Niektóre tworzą bardzo cienkie płytki, które ukazują barwy interferencyjne gdy światło odbija się z obu ich powierzchni, podobnie jak warstewka oleju na wodzie lub bańka mydlana. (patrz rozdział o bizmucie.)
Naftalen nie jest rozpuszczalny w wodzie ani w alkoholu. Jeśli chcesz wyczyścić wnętrze kubka, możesz to zrobić przy użyciu płynu do usuwania lakieru z paznokci (zawierającego aceton), albo z pomocą benzenu. Oba są łatwo palne i nieco trujące, stosuj je więc przy dobrej wentylacji i z pomocą ręczników papierowych, które nie będą po użyciu stykały się z ogniem.
b. CO ROBIĆ Z KRYSZTAŁAMI
Małe cienkie płytki naftalenu są bardzo piękne pomiędzy skrzyżowanymi polaryzatorami, oglądane przez szkło powiększające. Barwy, które ukazują kryształy między skrzyżowanymi polaryzatorami, nie pochodzą z odbicia światła od dwóch bliskich powierzchni jak w bańce mydlanej. Pochodzą one stąd, że wewnątrz kryształu światło jest rozdzielone na dwa promienie biegnące z rożna prędkością. To interferencja między tymi różnie zmienionymi promieniami tworzy barwy.
c. NAUKA Z TEGO ROZDZIAŁU
Także inne niż woda substancje mogą być krystalizowane bezpośrednio ze stanu pary.
D. DOŚWIADCZENIA ZE ŚWIATŁEM SPOLARYZOWANYM
1. NATURA ŚWIATŁA SPOLARYZOWANEGO I METOGY JEGO OTRZYMYWANIA
Pojęcie o świetle, którego używamy w danych warunkach,, zależy od tych warunków. W naszej sytuacji wygodnie jest myśleć o świetle mającym naturę falową – jako zaburzeniu które przemieszcza się jako ruch oscylacyjny podobny do fali na jeziorze. Musimy jednak myśleć o falach światła jako bardzo bardzo małych, o odległości między grzbietem a grzbietem około 5/10000 lub dwie tysięczne milimetra. ( dwa tysiące fal na główkę szpilki!)
W przeciwieństwie do fal na jeziorze, fale świetlne nie oscylują w górę i w dół. Oscylują one we wszystkich kierunkach prostopadłych do kierunku biegu światła. Jest jednak możliwe, aby światło przechodziło przez coś, co pozwoli mu oscylować tylko w jednej szczególnej płaszczyźnie. Światło oscylujące tylko w jednej płaszczyźnie nazywa się światłem spolaryzowanym liniowo, lub często wprost światłem spolaryzowanym. Rzecz powodująca polaryzację światła nazywa się polaryzatorem. Istnieje wiele rodzajów polaryzatorów. Każda gładka, niemetaliczna powierzchnia, która odbija światło, częściowo je polaryzuje. Światło spolaryzowane przez taką powierzchnię, oscyluje równolegle do tej powierzchni (i oczywiście, zawsze prostopadle do kierunku biegu światła). Prawdopodobnie najwygodniejszym polaryzatorem do badania kryształów opisanych w tym podręczniku jest błona polaryzująca. Jeden gatunek jest produkowany od wielu lat jako Polaroid, ale są i inne.
Taka błona przepuszcza głównie światło oscylujące w jednym kierunku w płaszczyźnie błony. Możesz stwierdzić, który to jest kierunek, patrząc przez tę błonę na światło odbite od niemetalicznej gładkiej powierzchni, na przykład malowanego parapetu okna. Kiedy parapet wygląda ciemniejszy, gdy patrzysz na niego przez błonę, dozwolony kierunek oscylacji światła przechodzącego przez błonę jest prostopadły do parapetu okna.
2. KRYSZTAŁY MIĘZY SKRYYŻOWANYMI POLARYZATORAMI
Wygodny sposób trzymania dwóch polaryzatorów do badania kryształów, to umieścić je na przeciwległych (otwartych) stronach małego pudełka i przymocować je do pudełka taśmą przylepną.
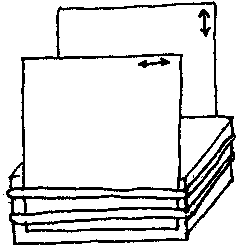
Podwójne strzałki zaznaczone na brzegu ukazują dozwolony kierunek polaryzacji światła przechodzącego przez każdy polaryzator. Kiedy polaryzatory są ustawione w ten sposób, że kierunek polaryzacji w jednym jest prostopadły do drugiego, mówimy że polaryzatory są „skrzyżowane”. Gdyby polaryzatory były doskonałe, światło nie mogłoby przejść przez nie, kiedy są skrzyżowane. Nie znając kierunku polaryzacji któregoś z nich, możesz je ustawić w położeniu skrzyżowanym, przez znalezienie położenia, w którym wyglądają najciemniej, gdy umieszczone są jeden nad drugim.
Pełna dyskusja o kryształach w świetle spolaryzowanym nie jest możliwa w tym podręczniku.
Czytelnik może znaleźć więcej wiadomości w podręcznikach spisanych w Części V.
Specjalne obserwacje na kryształach opisanych w tym podręczniku są następujące.
Powyższe kryształy mogą być podzielone na dwie grupy na podstawie ich zachowania między skrzyżowanymi polaryzatorami.
Kryształy, które są zaciemnione we wszystkich położeniach: sól kuchenna, ałun.
Kryształy, które rozjaśniają pole widzenia w większości położeń: boraks, siarczan miedzi, cukier, siarczan magnezu, lód, salicylan fenylu, naftalen.
Należy dostrzec, że te które świecą w większości położeń, są zaciemnione w niektórych położeniach. Na przykład igły siarczanu magnezu, są zaciemnione, gdy ich długie krawędzie są równoległe do dozwolonego kierunku któregoś z polaryzatorów.
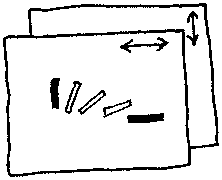
Każdy kryształ, który rozjaśnia się między skrzyżowanymi polaryzatorami, ukaże barwy
gdy będzie wystarczająco cienki. Gdy światło przechodzi przez taki kryształ, dzieli się na dwa promienie oscylujące pod kątem prostym, jeden względem drugiego. Jeden z nich ma większą szybkość niż drugi. Kiedy te dwa promienie wyjdą z kryształu i trafią w drugi polaryzator, interferują za sobą w sposób podobny do tego jak opisany w rozdziale o kryształach bizmutu. Choć przyczyna interferencji jest tu inna, te barwy też są barwami interferencyjnymi.
Polaryzatory są szczególnie użyteczne dla odróżnienia, czy kawałek materii to monokryształ, czy składa się z wielu kryształów. Częściowo stopiony kawałek lodu nie ukazuje granic między kryształami w zwykłym świetle, ale pomiędzy skrzyżowanymi polaryzatorami możesz zobaczyć, że połowa jest zaciemniona w jednym położeniu, a druga część i innym.
Oczywiście w takim przypadku obiekt składa się z dwóch kryształów.
3. LÓD I MIKA
W rozdziale na temat lodu opisano figurę interferencyjną, czarny krzyż na szarym tle, który można zobaczyć w szczególnie sprzyjających warunkach. Nie jest to łatwe do zobaczenia. Trzeba mieć raczej gruby kawałek lodu o gładkich ścianach i ukazujący obszar zaciemniony we wszystkich położeniach przy obrocie kryształu, gdy płytka jest równoległa do polaryzatorów.
Inną figurę interferencyjną, z dwoma „oczami” zamiast jednego, można zobaczyć w podobny sposób na dużym kawałku miki między skrzyżowanymi polaryzatorami. Oko obserwatora musi być tak blisko płytki miki jak to tylko jest możliwe. Ponieważ mika nie uszkadza polaryzatorów, jak to było w przypadku lodu, mogą one stykać się z miką po obu jej stronach. Jeśli taki sandwicz obracać tam i z powrotem pod różnymi kątami względem linii wzroku, można będzie ujrzeć „dwoje oczu”. Pełniejszy opis figur interferencyjnych można znaleźć w książce „Crystals and Light" jednej z rekomendowanych w rozdziale V.
4. ROZTWORY CUKRU
Fakt, że kryształ błyszczy między skrzyżowanymi polaryzatorami nie znaczy, że skręca on płaszczyznę światła spolaryzowanego. Jeśli można go obrócić o pewien kąt, pod którym wygląda jak czarny, nie jest on czynny optycznie. Czynny optycznie jest roztwór cukru - skręca on płaszczyznę światła spolaryzowanego. Znaczy to, że w trakcie przechodzenia światła przez roztwór, kierunek oscylacji światła zmienia się stopniowo zgodnie z ruchem śrubowym.
Gdyby roztwór cukru skręcał płaszczyznę światła spolaryzowanego tak samo dla wszystkich barw, wówczas można by obrócić jeden polaryzator względem drugiego o odpowiedni kąt i roztwór byłby czarny między tak ustawionymi polaryzatorami. Jednakże płaszczyzna polaryzacji dla każdej barwy światła skręca się o różny kąt dla danej długości drogi w roztworze. Dlatego, kiedy bliższy polaryzator obrócimy o właściwy kąt, aby był „skrzyżowany” dla tej barwy, inne barwy nadal przechodzą. Zaciemnienie uzyskamy, gdy źródło wytwarza światło jednobarwne. Można to doświadczenie przeprowadzić stosując (jako filtr) kawałek szkła lub plastyku w kolorze czerwonym, niebieskim, lub żółtym.
KRYSZTAŁY POZA DOMEM I SZKOŁĄ
A. W Muzeum
1. WYSTAWY SKAŁ I MINERAŁÓW
Większość muzeów wystawia okazy skał i minerałów; niektóre są bardzo piękne. Minerały to kryształy, które znajdują się w skorupie ziemskiej. Wycieczka do muzeum będzie dobrym wprowadzeniem do szukania kryształów, które znajdują się na dworze.
2. PERSONEL MUZEUM ( RADY CO DO WYCIECZEK W TEREN)
Pracownicy muzeum mogą doradzić wam, gdzie należy szukać kryształów. Kryształy w skałach rosną zwykle naprzeciw siebie i tworzą nieregularne granice, niemniej są one kryształami. Musisz wyjaśnić pracownikom muzeum, że chciałbyś zbierać minerały tworzące skały bez pięknie błyszczących ścian, a także kryształy o bardziej doskonałych kształtach zewnętrznych.
B. W TERENIE (wycieczka terenowa)
Jeśli mieszkasz w miejscu, gdzie występują nagie skały, możesz znaleźć skały wulkaniczne
(powstałe ze stopionej lawy) , skały osadowe ( osadzane na dnie zbiorników wodnych), lub skały metamorficzne ( zmienione przez wysoką temperaturę i ciśnienie, choć powstawały jako skały wulkaniczne lub osadowe).
1.Skały wulkaniczne, które stygły wolno, zawierają duże ziarna minerałów składowych, gdyż niewiele kryształów zaczynało w lawie krystalizować równocześnie i każdy mógł urosnąć duży, zanim zetknął się z sąsiednim kryształem. Powstawały one głęboko pod powierzchnią ziemi. (Olbrzymie kryształy mogą powstawać, kiedy bogata w wodę płynna substancja trafia w szczeliny skał i rozpoczyna się powolna krystalizacja z roztworu wodnego). Minerały jakie zwykle powstają w takich warunkach to: kwarc ( szary lub bezbarwny, o wyglądzie szkła, niełupliwy); szpat polny (skaleń) (różowy, biały lub szary, matowy, łupliwy); mika (bezbarwna, szara lub czarna, doskonała łupliwość, łuszcząca się w cienkie płytki); hornblenda (czarne, krótkie laski, niemal niedostrzegalna łupliwość, małe ziarna). Kiedy stopiona skała stygnie szybko, jest drobnoziarnista i wówczas trudniej w niej rozróżnić poszczególne minerały, ale zwykle są to te same składniki.
2.Skały osadowe powstają, gdy warstwy składników znoszone przez strumienie i rzeki do morza, twardnieją w skałę. Te fragmenty pochodzą ze skał wulkanicznych, dlatego możesz oczekiwać, że tu znów znajdziesz te same minerały. Jednakże szpat polny i mika niszczeją w trakcie transportu i szybciej rozkładają się chemicznie. Kwarc jest twardszy, niełupliwy, dlatego lepiej znosi ścieranie. Jest także odporny chemicznie. Dlatego zwycięża. Kwarc jest najbardziej popularną skałą osadową jako piaskowiec i łupek (bardziej drobnoziarnisty). Rzeki transportują również materię w postaci roztworu. Jedną z najpospolitszych substancji wytrącanych z roztworu jest węglan wapnia. Kiedy staje się twardą skałą, jest dobrze teksturowany, lekko szary lub niemal biały. Nazywa się wapieniem. Minerał, który tworzy wapień, to kalcyt. Kalcyt także wytrąca się z wody w postaci białych żył w różnych rodzajach skał. Łatwo go zidentyfikować dzięki doskonałej łupliwości w trzech kierunkach, co powoduje, że pęka on tworząc małe bloki. Brzegi bloków nie są prostokątne jak w soli kamiennej, ale posiadają kształt rombów (kształt równoległościanów).
3.Skały metamorficzne powstają ze skał wulkanicznych i osadowych w wyniku działania ciepła i ciśnienia, głęboko w Ziemi, nieraz z udziałem roztworów różnych substancji migrujących przez skały. Wapień po metamorfozie to marmur. Kryształy kalcytu stają się większe, niektóre rosną kosztem innych. Metamorfizm iłów daje iłołupki. Dalszy metamorfizm iłołupków prowadzi do łupków, skały pełnej miki, która błyszczy w promieniach słońca.
4.Otoczaki, kryształy górskie i piasek. Jeśli mieszkasz, gdzie nie widać dużych skał na powierzchni, podnieś małe kawałki skał, które możesz znaleźć. Często są one z wierzchu brudne i czasami ich powierzchnia uległa zmianom w wyniku działania czynników atmosferycznych. Rozbij je, aby odkryć świeżą powierzchnię. Jeśli nie mieszkasz na zboczu wulkanu, wszystkie znalezione kamyki będą krystaliczne, to znaczy będą zbudowane z kryształów, choć mogą one być małe i o nieregularnych granicach.
Przypisywanie nazwy ziarnom krystalicznym w skale, to tylko część przyjemności z nauki o skałach i nie tak ważna jak badanie zależności między nimi. Możesz powiedzieć, czy skała jest pochodzenia wulkanicznego, osadowa lub metamorficzna. Jeśli to skała wulkaniczna, spróbuj określić, które ziarna krystaliczne rosły jako pierwsze, przed innymi, które musiały przyjąć kształt zależny od przestrzeni jaka im pozostała.
5.Lód jest krystalicznym ciałem stałym, które powstaje w przyrodzie bez udziału człowieka, dlatego również nazywamy go minerałem. Szron na szybie okna wygląda jak pierzaste kryształy naftalenu. Sopel lodu jest czasem zbudowany na jednym krysztale lodu. Zbadaj jeden sopel między skrzyżowanymi polaryzatorami!
Być może najładniejszy ze wszystkich naturalnych kryształów jest ten, który zostawiliśmy na koniec – płatek śniegu. Jeśli mieszkasz, gdzie pada śnieg, wynieś swoje szkło powiększające na dwór, gdy pada drobny śnieg. Każdy płatek może być monokryształem. (duże płatki są zlepkami wielu kryształów.) Różnorodność wzorów płatków śniegu stanowi źródło zachwytu i przyjemności dla wszystkich , którzy lubią obserwować świat wokół nich. Różnorodność kształtów wynika prawdopodobnie stąd, że kształt małego kryształu jest bardzo wrażliwy na małe zmiany wilgotności i temperatury. Wielki badacz płatków śniegu, Ukichiro Nakaya odkrył, że można powodować różne typy wzrostu według życzenia, w laboratorium, przez sterowanie warunkami temperatury i wilgotności, w których wzrasta mały kryształek lodu. W burzy śnieżnej każdy kryształ doświadcza różnych zmian warunków w trakcie swego wzrostu. Dwa płatki, które rosną w ciągu kilku sekund w tych samych warunkach, będą potem przeniesione wiatrem daleko od siebie i będą kontynuowały wzrost w różnych warunkach. W stale zmieniających się warunkach i silnej wrażliwości na te zmiany można oczekiwać takiej różnorodności i tak złożonego piękna.
C. W dużych magazynach i małych sklepach
Polerowana skała wulkaniczna ukazująca biały szpat polny, szary kwarc i czarną mikę.
1. DEKORACJE BUDYNKÓW I LAD SKLEPOWYCH
Wiele dużych magazynów używa polerowanych skał, aby udekorować budynki na zewnątrz, a niekiedy i w środku. Tak wypolerowane powierzchnie przecinają kryształy, z których zbudowana jest skała. Granice pomiędzy jednym i drugim ziarnem łatwo dostrzec i można odróżnić pojedyncze ziarna krystaliczne od innych. Zwykle skała zbudowana jest nie więcej niż z trzech różnych minerałów, czasem tylko z jednego. Marmur (metamorficzny wapień) zbudowany jest niemal wyłącznie z mineralnego kalcytu. Jednakże najdroższy marmur używany do dekoracji zawiera zwykle inkluzje innych substancji, które decydują, że zachwyca barwą, która podwyższa jego dekoracyjność.
Jeśli zdarzy się że polerowana substancja przecina kryształ zgodnie z jego płaszczyzną łupliwości, kryształ ten może odbijać żywo światło słoneczne, jeśli będziesz patrzył pod odpowiednim kątem. Szukaj błyszczących płaszczyzn łupliwości kryształów przechodząc wzdłuż polerowanych płyt skalnych zdobiących budynek. Cała ta część, która odbija światło pod jednym kątem (która błyszczy, gdy stoisz w jednym miejscu), należy do jednego kryształu.
2. SKLEPY JUBILERSKIE
Niemal wszystkie kamienie szlachetne to monokryształy. Wyjątek stanowią nefryty i „kocie oczka” , które są polikrystaliczne i opal, który w ogóle nie jest kryształem. Wiele klejnotów jest szlifowanych z licznymi powierzchniami na wierzchu i na spodzie. Światło odbija się
od górnych ścianek, ale także wchodzi do klejnotu i odbija się od jego dolnych ścianek. To daje klejnotowi jego blask i zwraca się wielką uwagę, aby tak ciąć małe ścianki pod optymalnymi kątami , by uzyskać ten efekt.
3. APTEKI, DROGERIE
Wiele substancji, o których mówiono w tej książce, można kupić w drogerii. Jeśli powiesz drogiście, że jesteś zainteresowany hodowlą kryształów, może on dostarczyć ci jeszcze innych substancji. Upewnij się, czy nie istnieje jakieś niebezpieczeństwo przy stosowaniu danej substancji.
ZALECENIA CO DO DALSZEGO CZYTANIA
Znajomość kryształów, które sam wyhodowałeś lub znalazłeś w skałach może prowadzić do dalszego zainteresowania nimi. Zostały napisane setki książek na temat krystalografii i mógłbyś szukać ich w bibliotece. Ale początkujący może być czasem przytłoczony przez nadmiar informacji na raz. Przytoczona lista obejmuje jedną książkę o hodowli kryształów, jedną o skałach i minerałach i jedną o kryształach między skrzyżowanymi polaryzatorami.
Wszystkie trzy książki zawierają informacje o zewnętrznej symetrii idealnie ukształtowanych kryształów, symetrii, która wynika z ich uporządkowanej struktury. Każdy kryształ posiada takie uporządkowanie. Możesz stworzyć dla wielu z nich pomyślne warunki ukazywania jak rosną w pięknych kształtach , z jasno błyszczącymi ścianami.
SPIS LITERATURY
- Holden, A., d Singer, P. Crystals and Crystal Growing, Doubleday-Anchor, Garden City, NY, USA 1960.
- Pough, Frederick H. A Field Guide to Rocks and Minerals, Houghton Mifflin, Boston, USA 1960.
- Wood , Elizabeth A. Crystalls and Light, an Introduction to Optical Crystallography, Van Nostrand, Princeton, NJ, USA, 1964.
Polska literatura:
- Z. Bojarski, M. Gigla, K. Stróż, M. Surowiec, KRYSTALOGRAFIA. Podręcznik wspomagany komputerowo. Wydawnictwo Naukowe PWN, Warszawa 1996.
PODZIĘKOWANIE
Specjalne podziękowania Jovance Kink za przejrzenie i korektę oryginalnego podręcznika (Czerwiec 1993).
Prawa autorskie 1972, Międzynarodowa Unia Krystalografii